推荐产品
公司新闻/正文
文献解读|细胞囊泡原位生长抗氧化纳米晶用于高效清除活性氧和急性炎症性疾病的治疗
人阅读 发布时间:2021-09-24 10:14
活性氧(ROS)是炎症进展和损伤的关键因素。作者通过对急性炎症性疾病血管异常的临床观察和实验验证,纳米抗氧化剂具有高比表面积,可以借助其催化活性清除ROS,以此减少ROS引发的组织损伤并控制疾病进展,在治疗急性炎症性疾病领域具有广阔应用前景。但是,现有的纳米抗氧化剂(如氧化铈、氧化钼、氧化锰)在炎症组织中的蓄积量较低,其ROS清除能力也亟需进一步提升。作者提出以红细胞囊泡作为模板和载体来提高纳米抗氧化剂的治疗性能。具体而言,将氧化铈(Ce)纳米晶体原位生长到纳米大小的红细胞囊泡(ReV)上。Ce-ReV不仅具有优异的生物相容性,还有极高的活性氧清除活性,这一点在实验和理论上都可以通过发现氧化铈纳米晶超小尺寸的粒径(约3nm)和超高三价Ce含量(约60.8%)的独特功能来解释。在结肠炎和急性肝损伤模型中,Ce-ReV显著增强炎症部位的蓄积,并使ROS大量清除。此外,作者通过将ReV与间充质干细胞外泌体融合来升级该系统,并在此基础上原位生长氧化铈纳米晶(Ce-ReMeV),新系统展示了对高度受损组织的额外修复功能,进一步验证了令人满意的灵活性和治疗效果。
基本信息
题目:In situ growth of nano-antioxidants on cellular vesicles for efficient reactive oxygen species elimination in acute inflammatory diseases
期刊:Nano Today
影响因子:20.722
第一作者:赵佳伟a,b、王玉刚b
通讯作者:施敏b、魏炜a、马光辉a
作者单位:
a.中国科学院过程工程研究所生化工程国家重点实验室
b.上海交通大学医学院同仁医院
索莱宝合作产品:
| 产品名称 |
产品货号 |
| Mouse IL-1β ELISA KIT |
SEKM-0002 |
| Mouse IL-6 ELISA KIT |
SEKM-0007 |
| Mouse TNF-α ELISA KIT |
SEKM-0034 |
| Mouse Myeloperoxidase ELISA KIT |
SEKM-0118 |
| Micro Hydroxyl Free Radical Scavenging Capacity KIT |
BC1325 |
| Micro Superoxide Anion Assay KIT |
BC1295 |
| Cell Counting KIT-8(CCK-8) |
CK04 |
| Lipopolysaccharides(LPS) |
L8880 |
| HEPES |
H8090 |
| Coomassie Brilliant Blue R-250 |
C8430 |
摘 要
失控的炎症导致多种急性疾病的发病,如结肠炎和肝、肺和神经系统的急性损伤。急性炎症期间产生的活性氧(ROS)导致细胞膜氧化应激损伤和脂质过氧化,导致细胞膜通透性转换和DNA损伤,最终导致器官功能障碍。虽然现在已经很清楚减少或消除活性氧可以预防炎症和相关器官损伤,但传统的抗氧化剂(如维生素C、多酚、姜黄素)无法抑制由急性炎症诱导的活性氧的大量产生,这严重影响了治疗效果,限制了它们在临床上的应用。随着纳米科学和纳米技术的迅速发展,具有高效清除活性氧的纳米级抗氧化剂应运而生。一些研究报道了氧化铈纳米晶体用于治疗活性氧相关疾病,包括中风、败血症、眼表疾病、肝脏缺血再灌注损伤、急性肾损伤和阿尔茨海默病。除了强调这种材料的治疗潜力外,这些关于抗氧化剂纳米晶体在医学中的应用也面临着新挑战。例如,要确保氧化铈纳米晶体超小颗粒尺寸(最好小于5nm)以增加催化比表面积。此外,化学挑战在于增加三价铈的比例,以促进有效的抗氧化活性。生物学上的挑战是增加炎症组织中氧化铈纳米晶体的积累,因为这些外源性颗粒物质容易受到单核吞噬细胞系统(MPS)吞噬作用的快速清除。
在分析急性结肠炎和肝损伤的临床表现和小鼠模型后,炎症组织中的血流量显著升高,血管内皮破坏。根据这些病理观察和细胞膜与金属离子之间的静电相互作用,作者推测,使用细胞囊泡作为载体来改善靶向积累和模板材料来调节结晶过程可以克服抗氧化剂纳米晶体应用中的上述挑战。作者证明了氧化铈纳米晶体在纳米级红细胞(RBC)囊泡(ReV)膜上的原位生长能延长氧化铈纳米晶体在血液中的循环,并改善其在炎症组织中的蓄积。除了用作载体外,囊泡膜还可以用作模板,温和地优化纳米晶体的尺寸和Ce3+的比例,从而提高活性氧消除的效率。此外,作者通过将ReV与间充质干细胞(MSC)衍生的外泌体融合,进一步开发了该系统,为细胞囊泡提供了额外的特性,以修复高度受损的组织。上述优势已在小鼠结肠炎和肝损伤模型中得到系统验证,突出了这种新型抗氧化剂有效治疗急性炎症性疾病的潜力。
研究内容及结果
1.结肠炎疾病相关的病理生理学
急性炎症组织通常表现为血流动力学和血管系统异常。然而,这种病理生理学特征尚未被充分用于治疗急性炎症性疾病,尤其是结肠炎。因此,作者收集了结肠炎患者和健康志愿者的腹部彩色多普勒超声影像,并比较了血流动力学特征(图1a)。结肠炎患者肠系膜上动脉(SMA)的血流速度高于健康的志愿者(图1b)。从数量上讲,结肠炎患者的最大流速和平均流速大约是健康志愿者的1.3倍。结肠炎患者通过SMA的流量是健康志愿者的1.6倍(图1c)。此外,作者研究了经典右旋糖酐硫酸钠(DSS)诱导的结肠炎小鼠模型中炎症相关疾病的病理生理学(图1d)。彩色多普勒超声检查显示炎症结肠组织中的血流信号增加。双光子荧光显微镜测量降结肠微血管的流量,结果显示结肠炎小鼠的血流量比健康小鼠增加1.7倍(图1e,f)。作者同时使用双光子荧光显微镜进行荧光素血管造影,以直接评估血管结构的破坏,这在结肠炎小鼠中可以清楚地观察到渗漏,而在健康小鼠中几乎没有(图1g和S1)。为了获得更深入的了解,作者对血管完整性进行了详细的组织学检查。扫描电子显微镜(SEM)分析显示,与健康小鼠的完整血管屏障相比,结肠炎小鼠的血管内皮完整性明显受损,血管屏障上的缺陷变宽(图1h),从而导致结肠炎小鼠的血管高荧光渗漏。

图1 结肠炎患者和小鼠的血流速度增加,
结肠血管内皮被破坏
2.ReV在结肠炎组织中的有效蓄积情况
受红细胞循环持续时间的启发,红细胞表达膜蛋白,如CD47,有助于防止被MPS清除,作者首先选择微尺寸的RBC(约5.8µm)和纳米尺寸的ReV(约140nm),以比较大小对累积的影响(图2a)。此外,作者选择了与ReV大小相似的聚乳酸-乙醇酸纳米颗粒(NPs),以比较不同材料的累积能力。作者通过监测静脉注射后的循环持续时间来比较这三种携带者。健康小鼠和结肠炎小鼠(由3%DSS诱导)的结果相似。具体而言,NPs被迅速清除,半衰期短约1.2小时,而RBC和ReV的半衰期则长得多(图2b)。对于外渗,作者使用四甲基罗丹明异硫氰酸酯–右旋糖酐作为血管内对比剂,在体内进行双光子荧光显微镜检查(图2c和d)。在健康组织和结肠炎组织中,NPs的短循环几乎不会导致血管的信号外渗。尽管长循环的红细胞可以稍微改善这种情况,但它们的微小尺寸限制了结肠炎患者通过血管内皮细胞破裂的间隙进行的外渗。值得注意的是,具有长循环和纳米尺寸的ReV显著改善了其外渗,尤其是在结肠炎组织中。因此,主要器官(结肠、心脏、肝脏、脾脏、肺和肾脏)的离体成像显示纳米级ReV,而不是其他材料在结肠中显示出明显的堆积(图2e和S2)。为了定量,作者计算了结肠和肝脏中这些载体的强度比(图2f)。NPs和RBC的比率分别为0.09和0.2,健康和结肠炎小鼠之间无显著差异。相反,健康小鼠的ReV比率约为0.35,结肠炎小鼠的ReV比率甚至达到0.9。在荧光信号方面,特别是在炎症结肠中,ReV的荧光信号比RBC高约4.5倍,比NPs高10.4倍,这表明ReV是作为治疗肠道炎症疾病载体材料的好候选材料。

图2 探索ReV在结肠炎组织中的有效蓄积
3.氧化铈纳米颗粒功能化ReV
据报道氧化铈纳米颗粒是一种有前途的活性氧清除材料,ReV作为炎症部位聚集的优良载体,作者接下来用氧化铈纳米颗粒功能化ReV,以提高对结肠炎的治疗性能。为此,作者开发了一种单一且温和的一锅法。从健康小鼠的抗凝管中收集红细胞,并制备纳米级ReV,在Ce3+溶液(1mM,pH=6.2)中培养。由于静电作用,Ce3+可以吸附在ReV膜上。去除多余的Ce3+并将介质pH值调节至7.4后,在ReV膜上原位生长氧化铈纳米晶体(图3a),通过透射电子显微镜(TEM)图像(图3b)和能量色散光谱(EDS)元素分析(图3c)进行验证。结果显示,Ce-ReV保留了与ReV相似的形态和尺寸(图S3a),而在ReV膜上观察到许多直径小于3nm的氧化铈纳米晶体。使用电感耦合等离子体(ICP)-质谱(ICP-MS),发现铈的负载量约为1.6 μg/1011个囊泡。有了Ce-ReV,作者使用电子自旋共振(ESR)光谱进一步测试了Ce-ReV的ROS清除性能。向分析物溶液中添加Ce-ReV后,羟基自由基、氮自由基和超氧阴离子的水平以剂量依赖的方式明显降低(图3d)。以20µg/mL(Ce质量)的剂量为例,Ce-ReV可以完全清除三种类型的ROS,其光谱接近基线。然而,当使用相同剂量的传统CeO2 NP进行比较时,ESR信号的振幅降低。
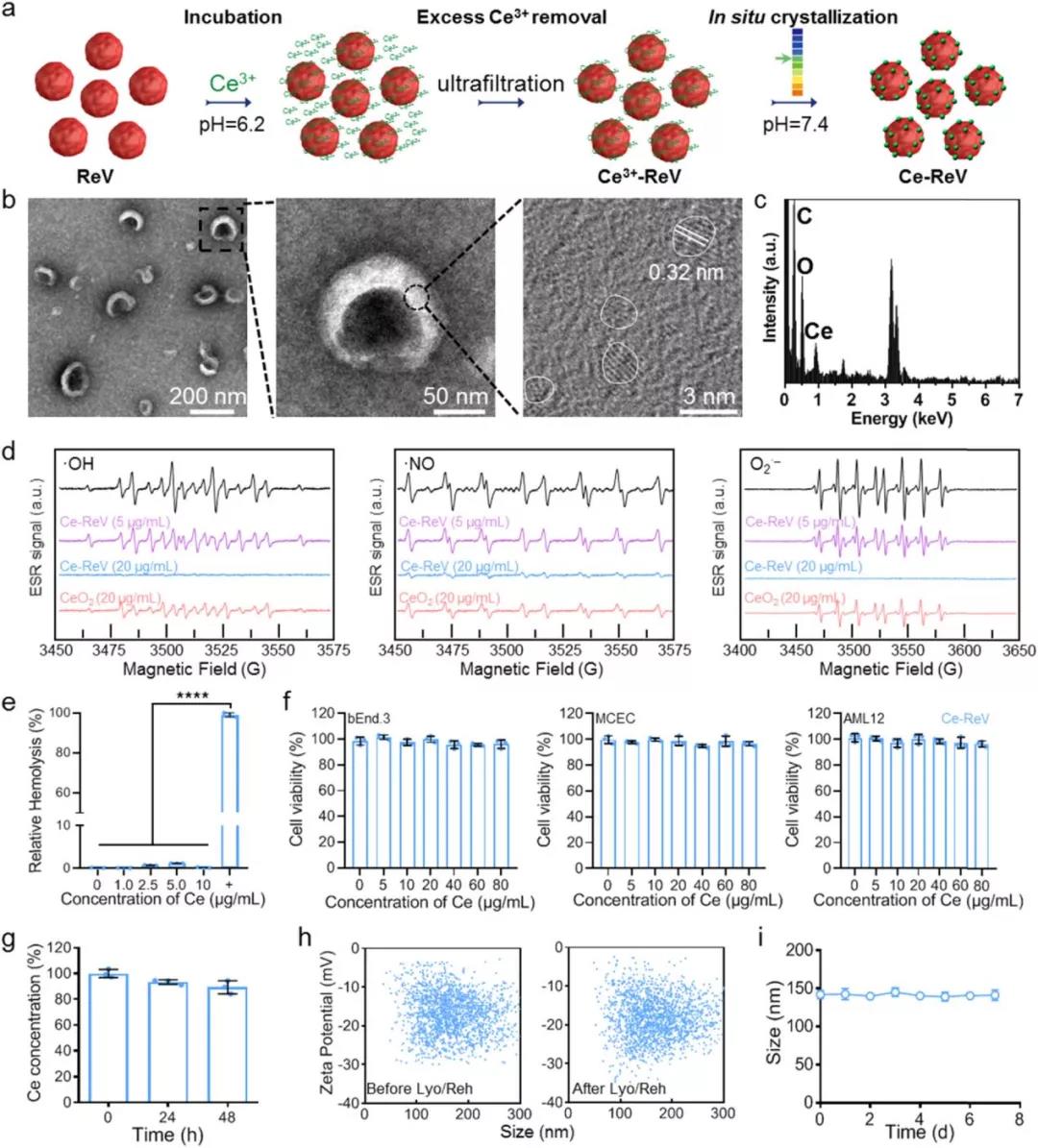
图3 原位氧化铈结晶小鼠红细胞囊泡的
制备和表征(Ce-ReV)
为了验证Ce-ReV活性氧清除性能强于传统CeO2 NPs,作者使用活性氧清除检测试剂盒进行定量检测。正如预期的那样,在同等Ce质量下,Ce-ReV的ROS清除活性大约比CeO2 NP高3倍(图S4),因此强调了ReV作为活性增强的氧化铈原位生长模板的作用。除了氧化铈纳米晶体,作者还进一步研究了它们对ReV的影响。由于制备条件非常温和,SDS-PAGE分析显示结晶后膜蛋白组分没有明显变化(图S3b)。特别是,Western Blotting(图S3c)显示Ce-ReV和ReV表达相似水平的CD47,这导致了相似的循环行为。考虑到氧化铈纳米晶体的参与,作者评估了Ce-ReV的生物相容性和稳定性。正如预期的那样,与红细胞混合后未观察到明显的溶血(图3e和S5a),与各种细胞系孵育后几乎未检测到细胞毒性(图3f),静脉注射Ce-ReV后未观察到对血液循环和血管结构的影响(图S6和S7)。就稳定性而言,在含有10%胎牛血清(FBS)的细胞培养基中培养48小时后,Ce-ReV中的Ce含量保持在90%以上(图3g),这表明很少有氧化铈纳米晶体从ReV中分离。此外,在冻干/复水循环之前(左)或之后(右)(图3h)或在4°C磷酸盐缓冲盐水(PBS)中储存1周期间(图3i),未观察到颗粒大小或zeta电位的明显变化。使用人类的红细胞时,也可以观察到具有良好活性、生物相容性和稳定性的氧化铈成功原位生长的类似结果(图S8和S5b)。
4.探究ReV上氧化铈纳米晶生长机理
据报道,氧化铈纳米晶的尺寸和铈价态是活性氧清除性能的两个重要因素。具体来说,较小的尺寸可以释放更多的氧气并增加更多催化部位的表面积比,并且根据Ce3+状态的比例可以实现更多的氧气不足以提高催化活性。因此,作者接下来评估ReV这两个方面的组成部分的影响。鉴于细胞囊泡主要由蛋白质和脂质组成,作者首先使用TEM研究了在蛋白质(牛血清白蛋白)和脂质(1-棕榈酰基-2-油酰基卵磷脂,POPC)膜存在下氧化铈结晶的过程。同时,将水和水热条件下的结晶作为对比(图4a)。POPC存在下形成的氧化铈具有超小的尺寸,这与在ReV膜上观察到的尺寸相似(小于3 nm),而在其他条件下形成的氧化铈显示出更大的尺寸或明显的聚集。
X射线光电子能谱(XPS)分析表明,膜和POPC反应生成的氧化铈纳米晶体中三价铈离子的比例最高(高达60.8%)(图4b)。为了证实脂质分子的重要作用,作者使用Cyro-TEM观察氧化铈在POPC膜上随时间变化的结晶(图4c)。由于Ce3+的预吸附,一次氧化铈成核最初发生在膜上。随着时间的推移,成核逐渐长大并形成超小型氧化铈纳米晶体。作者进行了一系列密度泛函理论(DFT)计算,以更好地理解氧化铈结晶过程中脂质分子的潜在机制(图4d)。计算数据表明,在脂质存在下,氧化铈纳米晶的形成有两个因素:电荷转移和成核势垒。具体而言,POPC的存在削弱了Ce3+在水系统中的电荷转移,从2.35e降低到1.61e,促进了较高比例的Ce3+。此外,POPC的存在将氧化铈纳米晶的成核势垒从水系统中的189.60降低到87.77,最终导致形成更小尺寸的氧化铈纳米晶(图4e,f)。这些结果有助于理解氧化铈纳米晶体的表面积和价态是如何被脂质分子操纵的,而这种模板效应以前从未实现过。

图4 ReV上氧化铈纳米晶生长机理
5.Ce-ReV的治疗效果与潜在机制
在DSS诱导的结肠炎小鼠模型中测试了Ce-ReV的治疗潜力。在第1天、第3天和第5天,这些小鼠静脉注射PBS、ReV、CeO2或Ce-ReV(Ce的等效剂量为800μg/kg)。为了评估整体治疗效果,在9天内记录体重变化,并在第9天对小鼠实施an le死,以测量结肠长度(图5a)。正如预期的那样,ReV单独治疗在体重减轻和结肠长度减少方面没有显示任何治疗效果,这与PBS治疗组相似。由于催化活性不理想,传统的CeO2及其在结肠炎组织中积累不足(图S9),使用CeO2治疗未能实现体重和结肠长度的实质性改善。相反的是,与健康组相比,在炎症结肠组织中具有强催化活性和有效积累的Ce-ReV在结肠炎小鼠中显示出良好的治疗效果,体重和结肠长度仅略有减少(约5%)(图5b,c)。
为了更好地理解Ce-ReV治疗效果的潜在机制,作者进行了二氢yi胺(DHE)染色以检测结肠组织中ROS的数量(图5d-f)。Ce-ReV治疗组的三维(3D)重建双光子显微图像和冰冻切片结肠组织显示的信号强度均比PBS、ReV和CeO2治疗组弱得多。ROS产生的显著数量促使作者进一步研究其与炎症的关系;因此,作者进行了转录组分析,差异表达基因的层次聚类分析显示,Ce-ReV治疗显著下调已知的炎症基因(如Ifi202b、Il11和Tlr2),限制炎症反应的基因(如RasGRP3和Cd83)同时上调(图5g)。KEGG分析揭示了已知炎症途径的丰富,如肿瘤坏死因子α(TNF-α)和白细胞介素17(IL-17)信号途径(图5h)。酶联免疫吸附试验(ELISA)进一步证实了Ce-ReV治疗的抗炎作用,该实验显示促炎细胞因子(IL-1β、IL-6和TNF-α)和髓过氧化物酶(MPO)的水平受到显著抑制(图5i)。结果表明炎性细胞浸润和隐窝缺失均被显著抑制(图5j和S10)。值得注意的是,Ce-ReV的良好治疗效果也得到了临床上广泛使用的其他传统结肠炎疗法(如5-ASA和地塞米松)优势的证实。以结肠长度为例,与健康小鼠相比,Ce-ReV组仅显示约5.7%的减少,而5-ASA治疗后仍观察到约25.5%的减少(图S11)。除治疗结果外,Ce-ReV治疗没有在健康小鼠中诱发任何可检测的全身毒性(图S12),包括体重、血液学、血液化学和主要器官组织学特征的变化。总的来看,这些体内实验结果支持Ce-ReV作为一种安全有效的治疗药物,用于对抗3%DDS诱导的结肠炎小鼠模型。

图5 Ce-ReV对DSS诱导的
结肠炎小鼠模型的治疗作用
6.Ce-ReV与MSC外泌体融合增强治疗效果
考虑到一些病情较重的结肠炎患者遭受组织损伤,作者猜测有可能通过将生物因子纳入Ce-ReV以增加组织修复功能来进一步增强治疗效果。鉴于从间充质干细胞制备的外泌体含有多种生长因子的报道,作者设想Ce-ReV与MSC外泌体的融合可以实现上述目标(图6a)。首先,作者从小鼠中提取骨髓间充质干细胞,并对其特性进行表征(图S13a和b)。ReV与MSC衍生的外泌体融合后(图S13c),作者进行激光共聚焦扫描显微镜(CLSM)成像,以确认ReV和MSC衍生的外泌体重叠信号中存在杂交小泡(图6b)。通过SDS-PAGE,可在ReMeV上鉴定这两种类型囊泡的膜蛋白,表明囊泡杂交后大部分成分保留(图S14a)。具体而言,Ce-ReMeV的Western Blotting证实Re存在膜标记热休克蛋白70(HSP70)和TSG101,MSC衍生外泌体存在膜标记HSP70、TSG101、CD9和内因子肝细胞生长因子(HGF)(图6c和S15)。
作者成功地在杂交膜上原位生长氧化铈纳米晶体,这可以通过高分辨率TEM和EDS元素分析进行验证(图6d和S14b)。晶体的尺寸小于3nm,Ce3+的比例仍然在60%左右,确保了高ROS清除活性(图6e)。在成功构建Ce-ReMeV后,作者进一步测试了Ce-ReMeV和Ce-ReV对5%DSS诱导的严重结肠炎小鼠模型的治疗潜力。实验设计与3%DSS诱导模型相似,只是由于结肠炎的迅速恶化,对体重进行了7天的观察(图6f)。与观察期内体重迅速下降且死亡率为37.5%的PBS治疗组相比,Ce-ReV和Ce-ReMeV治疗组体重均下降,且两组均无死亡(图6g)。值得注意的是,Ce-ReMeV治疗组的小鼠比Ce-ReV治疗组的小鼠体重减轻较少,这表明与MSC衍生的外泌体杂交具有一定的治疗益处。因此,与健康小鼠相比,PBS处理小鼠的结肠长度显著减少,而Ce-ReMeV处理小鼠的结肠长度仅略有减少(1cm)(图6h和S16a)。

图6 含ReV和间充质干细胞衍生外泌体与
原位结晶氧化铈(Ce-ReMeV)囊泡的构建及
对严重DSS诱导的结肠炎小鼠模型的治疗性能
为了更好地理解Ce-MeReV对严重结肠炎进一步改善治疗效果的潜在机制,作者继续研究ROS和炎症的作用。Ce-ReV治疗组ROS水平降低,炎症细胞因子水平受到抑制,与Ce-ReV治疗组相比,Ce-ReMeV治疗可获得更好的结果(图6i、j和S16b)。在组织修复方面,HE染色显示Ce-ReMeV通过减少隐窝缺失而优于Ce-ReV,导致结肠损伤评分更低(图6k和S16c)。Ce-ReMeV组如此良好的组织修复效果应归功于氧化铈纳米晶体清除活性氧和MSC外泌体生物因子的协同作用。鉴于严重结肠炎导致微生物群失衡,作者检查了Ce-ReMeV治疗是否调节了结肠炎小鼠肠道微生物群的组成。通过对V4区域的16S核糖体RNA(rRNA)基因测序对粪便样本进行分析表明,与其他治疗组相比,Ce-ReMeV处理显著提高了结肠炎小鼠的细菌丰富度,包括OTU丰富度、Chao1多样性指数、香农多样性指数和辛普森多样性指数(图6l,m)。进一步的家族水平分析表明,Ce-ReMeV处理显著增加了鼠杆菌科、普雷沃菌科和类杆菌科的相对丰度(图6n和S16d)。因此,这些结果证明了红细胞囊泡与MSC外泌体结合的概念,并证明了Ce-ReMeV对具有广泛组织损伤的极严重结肠炎模型的良好治疗效果。
为了将作者的研究范围扩大到结肠炎之外,作者招募了ALI患者进行腹部超声分析(图7a)。彩色多普勒超声数据显示,与健康志愿者(n=37)相比,ALI患者(n=34)的门静脉血流速度显著增加(增加1.35倍)。与健康小鼠相比,ALI小鼠的血流量增加了1.45倍,观察到了类似的结果(图7b、c和S17)。为了研究血管内皮的潜在破坏,作者对小鼠实施an le死,并使用扫描电镜观察固定的肝组织(图7d)。与血管屏障完整的健康组相比,ALI组显示出血管内皮完整性的破坏,血管屏障处的缺陷扩大就是例证。这些结果表明,炎症肝组织中存在血流速度增加和血管完整性破坏,这促使作者使用Ce-ReMeV治疗ALI。
接下来,作者使用ALI小鼠模型来评估Ce-ReV和Ce-ReMeV的治疗效果(图7e)。在24小时内每小时监测小鼠存活情况,结果显示PBS治疗组8只ALI小鼠中有6只死亡。Ce-ReV治疗后,死亡小鼠数量减少到3只,这一情况得到改善。正如预期的那样,Ce-ReMeV治疗进一步提高了存活率,9小时时仅有一只小鼠死亡(图7f)。在使用双光子显微镜进行活体成像后,作者观察到存活数据与肝组织中的ROS水平高度相关(图7g)。与出现活性氧大量产生的PBS治疗组相比,Ce-ReV治疗组的活性氧水平明显降低,Ce-ReMeV治疗可进一步降低活性氧水平,接近健康对照组的水平(图7h)。
为了评估抗炎反应,转基因IFN-γ生物发光报告小鼠用于体内炎症成像。PBS治疗组的ALI小鼠在其腹部显示出强烈的生物发光信号。相反,Ce-ReV治疗的ALI小鼠腹部生物发光降低(图7i和S18),而Ce-ReMeV治疗组的信号强度被抑制到与健康对照组相似的水平。此外,使用ELISA分析受损肝组织的提取物(图7j),作者发现Ce-ReV和Ce-ReMeV治疗组的促炎细胞因子(IL-1β、IL-6和TNF-α)和MPO水平降低。肝组织H&E染色显示PBS处理的ALI小鼠有严重出血,而Ce-ReV处理的ALI小鼠肝切片的组织损伤程度明显降低,Ce-ReMeV处理组几乎没有异常(图7k)。通过显著抑制两种典型的肝功能血清标志物丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST),进一步证实了这种增强的治疗效果,表明Ce-ReMeV治疗的小鼠显著抑制了这两种标志物的水平(图7l)。此外,肝组织的TUNEL染色显示PBS处理的小鼠有明显的组织凋亡,而Ce-ReV和Ce-ReMeV处理的肝组织的凋亡率有下降趋势(图S19)。这些急性肝损伤患者的临床发现和ALI模型的实验结果扩展了作者在结肠炎研究中关于Ce-ReMeV治疗效用的发现,并证明了对炎症性肝病的发展具有强大的保护作用。

图7 急性肝损伤(ALI)的腹部超声特征和
Ce-ReMeV对ALI小鼠模型的治疗作用
研究结论
研究团队发展了细胞囊泡表面原位生长高催化活性纳米晶的新策略,借助红细胞囊泡表面的脂质与Ce3+的相互作用,有效降低了氧化铈纳米晶生长的能量壁垒,使晶体的粒径降低至3nm。并且将三价氧化铈的比例提高至60.8%,大幅度增加了其对ROS的清除能力。除此之外,红细胞囊泡和具有组织修复功能的干细胞外泌体融合(ReMeV),在此基础上原位生长氧化铈纳米晶(Ce-ReMeV),借助于长循环和出色的ROS清除能力,在有效清除ROS的同时,修复受损的组织和器官,延长了模型小鼠的生存期,在应对重症急性肠炎和急性肝损伤疾病中取得显著的治疗效果。
索莱宝产品亮点




相关产品
| 产品名称 |
产品货号 |
| Mouse IL-1β ELISA KIT |
SEKM-0002 |
| Human IL-1β ELISA KIT |
SEKH-0002 |
| Mouse IL-6 ELISA KIT |
SEKM-0007 |
| Human IL-6 ELISA KIT |
SEKH-0013 |
| Mouse TNF-α ELISA KIT |
SEKM-0034 |
| Human TNF-α ELISA KIT |
SEKH-0047 |
| Mouse Myeloperoxidase ELISA KIT |
SEKM-0118 |
| Rat Myeloperoxidase ELISA KIT |
SEKR-0073 |
| Micro Hydroxyl Free Radical Scavenging Capacity KIT |
BC1325 |
| Micro Superoxide Anion Assay KIT |
BC1295 |
| Cell Counting KIT-8(CCK-8) |
CK04 |
| Lipopolysaccharides(LPS) |
L8880 |
| HEPES |
H8090 |
| Coomassie Brilliant Blue R-250 |
C8430 |